Enllaç C-Pd

Els compostos d'organopal·ladi (o compostos orgànics del pal·ladi) són compostos químics que contenen un enllaç químic entre carboni (C) i pal·ladi (Pd) (enllaç C-Pd). La química de l'organopal·ladi és la ciència corresponent que explora les propietats, l'estructura i la reactivitat d'aquests compostos.
El pal·ladi s'utilitza sovint com a catalitzador en la reducció d'alquens i alquins amb hidrogen. Aquest procés implica la formació d'un enllaç covalent pal·ladi-carboni. El pal·ladi també és destacat en les reaccions d'acoblament carboni-carboni, com es demostra en les reaccions en tàndem.[1]
Cronologia de la química de l'organopal·ladi
- 1873 - A. N. Zaitsev informa de la reducció de la benzofenona sobre el pal·ladi amb hidrogen.
- 1894 - Phillips informa que el clorur de pal·ladi(II) es redueix a pal·ladi metàl·lic pel contacte amb l'etilè.[2]
- 1907 - La tecnologia d'autoclau introduïda per Vladimir Ipatieff fa possible la hidrogenació a alta pressió.
- 1956 - En el procés de Wacker, l'etilè i l'oxigen reaccionen a l'acetaldehid amb el catalitzador PdCl₂/CuCl₂.
- 1957 - Malatesta i Angoletta informen del tetrakis(trifenilfosfina)pal·ladi(0).
- 1972 - La reacció de Heck és una reacció d'acoblament d'un halogenur amb una olefina. Els intermedis Pd(0) estan implicats.
- 1973 - L'alquil·lació al·lílica asimètrica de Trost és una substitució nucleòfila.
- 1975 - L'acoblament de Sonogashira és una reacció d'acoblament d'alquins terminals amb halogenurs d'aril o vinil.
- 1994 - L'aminació de Buchwald-Hartwig catalitzada per Pd per a reaccions de formació d'enllaços C-N.
Pal·ladi(II)
Complexos alquens
A diferència del Ni(II), però similar al Pt(II), els halogenurs de Pd(II) formen una varietat de complexos alquens.
El primer exemple és el dicloro(1,5-ciclooctadiè)pal·ladi. En aquest complex, el diè es desplaça fàcilment, cosa que el converteix en un precursor preferit dels catalitzadors. En el procés Wacker (d'importància industrial), l'etilè es converteix en acetaldehid mitjançant un atac nucleòfil d'hidròxid sobre un intermedi Pd(II)-etilè seguit de la formació d'un complex d'alcohol vinílic.
-
 Cicle catalític per al procés Wacker, d'importància industrial, per a l'oxidació d'etilè a acetaldehid
Cicle catalític per al procés Wacker, d'importància industrial, per a l'oxidació d'etilè a acetaldehid
Els lligands de ful·lerè també s'uneixen amb pal·ladi (II).
L'acetat de pal·ladi(II) i els compostos relacionats són reactius comuns perquè els carboxilats són bons grups de sortida amb propietats bàsiques. Per exemple, s'ha demostrat que el trifluoroacetat de pal·ladi és efectiu en la descarboxilació aromàtica.[3]
Complexos al·lils
El complex icònic d'aquesta sèrie és el dímer de clorur d'al·lilpal·ladi (APC). Els compostos al·lílics amb grups sortints adequats reaccionen amb sals de pal·ladi (II) a complexos pi-al·lílics amb hapticitat 3. Aquests intermedis també reaccionen amb nucleòfils, per exemple carbanions derivats d'èsters malonats[4] o amb amines en aminació al·lílica[5] tal com es mostra a continuació.[Nota 1]
-
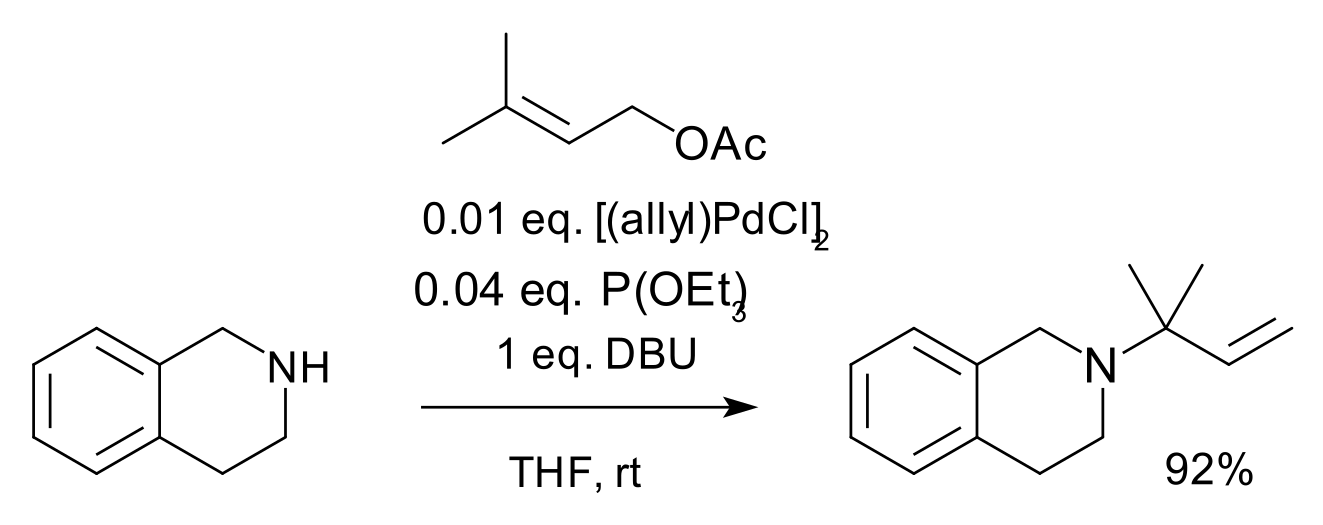 Aminació al·lílica
Aminació al·lílica
Els intermedis d'alilpal·ladi també apareixen en l'alquil·lació al·lílica asimètrica de Trost i la reordenació de Carroll, i una variació oxo en l'oxidació de Saegusa.
Complexos pal·ladi-carboni amb enllaç sigma
Diversos grups orgànics poden unir-se al pal·ladi i formar complexos estables d'enllaç sigma. L'estabilitat dels enllaços en termes d'energia de dissociació d'enllaços segueix la tendència: Pd-Alquinil > Pd-Vinil ≈ Pd-Aril > Pd-Alquil ; i la longitud de l'enllaç metall-carboni canvia en sentit contrari: Pd-Alquinil < Pd-Vinil ≈ Pd-Aril < Pd-Alquil.[6]
Compostos de pal·ladi(0)
Els compostos Pd(0) zerovalents inclouen tris(dibenzilidenoacetona)dipal·ladi(0) i tetrakis(trifenilfosfina)pal·ladi(0). Aquests complexos reaccionen amb hidrocarburs halogenats R-X en addició oxidativa als intermedis R-Pd-X amb enllaços covalents Pd-C. Aquesta química constitueix la base d'una gran classe de reaccions orgàniques anomenades reaccions d'acoblament (vegeu reaccions d'acoblament catalitzades per pal·ladi). Un exemple és la reacció de Sonogashira:
-
 Mecanisme de reacció de la reacció de Sonogashira
Mecanisme de reacció de la reacció de Sonogashira
Organopal·ladi(IV)
El primer compost d'organopal·ladi(IV) es va descriure l'any 1986. Aquest complex és Me₃Pd(IV)(I)bpy (bpy = lligand bidentat de 2,2'-bipiridina).[7] Es va sintetitzar mitjançant l'addició oxidativa de iodur de metil a Me₂Pd(II)bpy.
Els compostos de pal·ladi deuen la seva reactivitat a la facilitat d'interconversió entre els intermediaris Pd(0) i el Pd(II). Tanmateix, no hi ha proves concloents de la implicació de les conversions de Pd(II) a Pd(IV) en reaccions organometàl·liques mediades pel pal·ladi.[8] Una reacció que invoca aquest mecanisme es va descriure l'any 2000 i es refereix a una reacció de Heck. Aquesta reacció va anar acompanyada d'un desplaçament d'1,5-hidrogen en presència d'amines:[9]
-
![Reacció de Heck. [Wang 2000]](//upload.wikimedia.org/wikipedia/commons/thumb/1/14/HeckReactionWang2000.svg/1439px-HeckReactionWang2000.svg.png) Reacció de Heck. [Wang 2000]
Reacció de Heck. [Wang 2000]
Es va preveure que el canvi d'hidrur es fes a través d'un metal·locicle Pd(IV):
-
![Mecanismes de la reacció de Heck. [Wang 2000]](//upload.wikimedia.org/wikipedia/commons/thumb/9/92/HeckReactionWang2000Mechanism.svg/1467px-HeckReactionWang2000Mechanism.svg.png) Mecanismes de la reacció de Heck. [Wang 2000]
Mecanismes de la reacció de Heck. [Wang 2000]
En el treball relacionat, l'intermedi associat al desplaçament d'hidrur segueix sent Pd(II):[10]
-
![Organopal·ladi [Shift, Karig 2002]](//upload.wikimedia.org/wikipedia/commons/thumb/c/c8/OrganopalladiumShiftKarig2002.svg/1223px-OrganopalladiumShiftKarig2002.svg.png) Organopal·ladi [Shift, Karig 2002]
Organopal·ladi [Shift, Karig 2002]
i en altres treballs (una nova síntesi d'indoles amb dues migracions de Pd) es postulen equilibris entre diferents pal·ladicicles:[Nota 2][11]
-
![Desplaçament d'organopal·ladi [Larock 2004]](//upload.wikimedia.org/wikipedia/commons/thumb/b/b3/CPd_shift_Larock_2004_rev.svg/978px-CPd_shift_Larock_2004_rev.svg.png) Desplaçament d'organopal·ladi [Larock 2004]
Desplaçament d'organopal·ladi [Larock 2004]
i en determinats acoblaments intramoleculars es va demostrar el valor sintètic independentment de l'estat d'oxidació:[12]
-
![Migració d'organopal·ladi [Huang 2004]](//upload.wikimedia.org/wikipedia/commons/thumb/6/6a/OrganopalladiumMigrationHuang2004.svg/1366px-OrganopalladiumMigrationHuang2004.svg.png) Migració d'organopal·ladi [Huang 2004]
Migració d'organopal·ladi [Huang 2004]
Notes
- ↑ Reactius: lligand fosfit de trietil, DBU (es informa que absorbeix els protons d'amina que, d'altra manera, desencadenarien la isomerització) en THF.
- ↑ Reactius: difenilacetilè, acetat de pal·ladi, bis(difenilfosfí)metà (dppm) i la sal de cesi de l'àcid pivàlic (CsPiv).
Referències
- ↑ Wiley, 2002.
- ↑ Phillips, F. C. Am. Chem. J. (en anglès). 16, 1894, p. 255.
- ↑ Dickstein et al., Kozlowski, p. 2441-2444.
- ↑ Bäckvall i Vågberg, 1993, p. 5.
- ↑ Dubovyk, Watson i Yudin, 2007, p. 14172-14173.
- ↑ Ananikov, 2005, p. 715.
- ↑ Byers et al., 1986, p. 1722-1724.
- ↑ Mota i Dedieu, 2007, p. 9669-9678.
- ↑ Wang et al., 2000, p. 725-727.
- ↑ Karig et al., 2002, p. 3116.
- ↑ Zhao i Larock, 2005, p. 701.
- ↑ Huang et al., Larock, p. 7460-7461.
Bibliografia
- Ananikov, V. P «Theoretical Insight into the C−C Coupling Reactions of the Vinyl, Phenyl, Ethynyl, and Methyl Complexes of Palladium and Platinum» (en anglès). Organometallics, 24, 2005. DOI: 10.1021/om0490841.
- Bäckvall, Jan E; Vågberg, Jan O «Stereoselective 1,4-Functionalizations of Conjugated Dienes: cis- and trans-1-Acetoxy-4-(Dicarbomethoxymethyl)-2-Cyclohexene» (en anglès). Organic Syntheses, 1993.
- Byers, Peter K; Canty, Allan J; Skelton, Brian W; White, Allan H «The oxidative addition of lodomethane to [PdMe2(bpy)] and the X-ray structure of the organopalladium(IV) product fac-[PdMe3(bpy)l](bpy = 2,2-bipyridyl)» (en anglès). Chem. Commun., 23, 1986. DOI: 10.1039/C39860001722.
- Dickstein, Joshua S; Mulrooney, Carol A; Brien, Erin M; Morgan, Barbara J; Kozlowski, Marisa C «Development of a Catalytic Aromatic Decarboxylation Reaction» (en anglès). Org. Lett., 9(13), 2007. DOI: 10.1021/ol070749f. PMID: 17542594.
- Dubovyk, Igor; Watson, Iain D. G; Yudin, Andrei K «Chasing the Proton Culprit from Palladium-Catalyzed Allylic Amination» (en anglès). J. Am. Chem. Soc., 129(46), 2007. DOI: 10.1021/ja076659n. PMID: 17960935.
- Huang, Qinhua; Fazio, Alessia; Dai, Guangxiu; Campo, Marino A; Larock, Richard C «Pd-Catalyzed Alkyl to Aryl Migration and Cyclization: An Efficient Synthesis of Fused Polycycles via Multiple C-H Activation» (en anglès). J. Am. Chem. Soc., 126, 2004. DOI: 10.1021/ja047980y.
- Karig, Gunter; Moon, Maria-Teresa; Thasana, Nopporn; Gallagher, Timothy «C-H Activation and Palladium Migration within Biaryls under Heck Reaction Conditions» (en anglès). Org. Lett., 4(18), 2002. DOI: 10.1021/ol026426v.
- Mota, Antonio J; Dedieu, Alain «Through-Space Intramolecular Palladium Rearrangement in Substituted Aryl Complexes: Theoretical Study of the Aryl to Alkylpalladium Migration Process» (en anglès). J. Org. Chem., 72(25), 2007. DOI: 10.1021/jo701701s. PMID: 18001098.
- Wang, Liansheng; Pan, Yi; Jiang, Xin; Hu, Hongwen «Palladium catalyzed reaction of α-chloromethylnaphthalene with olefins» (en anglès). Tetrahedron Letters, 41(5), 2000. DOI: 10.1016/S0040-4039(99)02154-1.
- Wiley, John. Handbook of Organopalladium Chemistry for Organic Synthesis (en anglès), 2002. ISBN 0-471-31506-0.
- Zhao, Jian; Larock, Richard C «Synthesis of Substituted Carbazoles by a Vinylic to Aryl Palladium Migration Involving Domino C-H Activation Processes» (en anglès). Org. Lett., 7(4), 2005. DOI: 10.1021/ol0474655.



![Reacció de Heck. [Wang 2000]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/14/HeckReactionWang2000.svg/1439px-HeckReactionWang2000.svg.png)
![Mecanismes de la reacció de Heck. [Wang 2000]](http://upload.wikimedia.org/wikipedia/commons/thumb/9/92/HeckReactionWang2000Mechanism.svg/1467px-HeckReactionWang2000Mechanism.svg.png)
![Organopal·ladi [Shift, Karig 2002]](http://upload.wikimedia.org/wikipedia/commons/thumb/c/c8/OrganopalladiumShiftKarig2002.svg/1223px-OrganopalladiumShiftKarig2002.svg.png)
![Desplaçament d'organopal·ladi [Larock 2004]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b3/CPd_shift_Larock_2004_rev.svg/978px-CPd_shift_Larock_2004_rev.svg.png)
![Migració d'organopal·ladi [Huang 2004]](http://upload.wikimedia.org/wikipedia/commons/thumb/6/6a/OrganopalladiumMigrationHuang2004.svg/1366px-OrganopalladiumMigrationHuang2004.svg.png)

