Isotherme de Freundlich
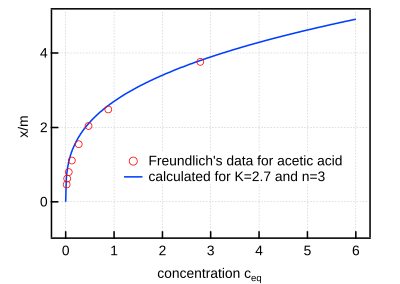
L’isotherme de Freundlich est une équation d’adsorption établie empiriquement par Herbert Freundlich en 1909. Initialement développée pour l'adsorption de gaz sur un adsorbant solide, elle peut être appliquée à une adsorption en solution. L'isotherme de Freundlich, par sa simplicité, est une isotherme populaire, tout comme l'isotherme de Langmuir. Leurs applications diffèrent cependant, car elles ne sont pas destinées aux mêmes types d'adsorption.
Équation
L'isotherme de Freundlich, tout comme son nom l'indique, est valide pour une température fixée. Elle établit qu'à l'équilibre chimique :
avec :
- la masse de particules adsorbée ;
- la masse d'adsorbant introduite dans le milieu ;
- la constante de Freundlich, caractéristique du milieu - elle dépend de l'adsorbat, l'adsorbant et la température ;
- la pression partielle en adsorbat à l'extérieur de l'adsorbant ;
- un entier naturel en théorie, un réel en pratique.
En solution, l'isotherme de Freundlich devient :
avec la concentration en adsorbat dans le milieu, et en notant le rapport des masses par la grandeur adimensionnelle .
Spécificités
Contrairement à l'isotherme de Langmuir, qui suppose une absorption mono-couche sur une surface homogène et uniforme, l'isotherme de Freundlich s'applique à des adsorptions multi-couche sur des surfaces hétérogènes.
Pour choisir l'isotherme s'appliquant le mieux à la situation étudiée, il est courant que les expérimentateurs se basent sur la meilleure corrélation entre loi et données, par exemple avec le coefficient de corrélation. Pourtant, pour effectuer un choix entre les isothermes, c'est l'enthalpie de réaction qui devrait trancher : une indépendante du nombre de sites occupés indique une surface homogène[2], tandis qu'une qui varie avec l'occupation des sites indique une surface inhomogène[3] et recommande donc l'emploi de l'isotherme de Freundlich.
Limites
L'isotherme de Freundlich en phase gazeuse ne prend pas en compte le phénomène de saturation de l'adsorbant. Ainsi, à hautes pressions, la quantité d'adsorbat que peut emmagasiner l'adsorbant ne dépend plus de la pression, car l'adsorbant est déjà saturé. Il faut alors considérer que dans l'isotherme, pour amoindrir la dépendance en pression.
Références
- ↑ Freundlich Herbert, Über die Adsorption in Lösungen." Zeitschrift für Physikalische Chemie – Stöchiometrie und Verwandschaftslehre., , p. 392 et 385–470
- ↑ Burke GM, Wurster DE, Buraphacheep V, Berg MJ, Veng-Pedersen P, Schottelius DD, Model selection for the adsorption of phenobarbital by activated charcoal. Pharm Res, (PMID 2023872, DOI 10.1023/a:1015800322286).
- ↑ A.W. Adamson, Physical chemistry of surfaces, (lire en ligne
 ), p. 699.
), p. 699.
 Portail de la chimie
Portail de la chimie























