Tiolok
 | Ez a szócikk feltüntet forrásokat, de azonosíthatatlan, hol használták fel őket a szövegben. Önmagában ez nem minősíti a szócikk tartalmát: az is lehet, hogy minden állítása pontos. Segíts lábjegyzetekkel ellátni az állításokat! Lásd még: A Wikipédia nem az első közlés helye |
 | Nem tévesztendő össze a következővel: tiofén. |
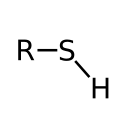
A tiolok kéntartalmú szerves vegyületek. Jellemző funkciós csoportjuk az – SH szulfanil – vagy szulfhidrilcsoport. Az alkoholokból vagy a fenolokból vezethetők le a bennük található hidroxilcsoport oxigénatomját kénatomra cserélve. Az alkoholokból levezethető tiolok a tioalkoholok vagy régies nevükön merkaptánok, a fenolokból levezethetőek a tiofenolok. A hidrogén-szulfidból is származtathatók annak egy hidrogénatomjának szénhidrogén–csoportra cserélésével. A szulfanilcsoport akár cikloalifás vagy heterociklusos gyűrűhöz is kapcsolódhat.
Fizikai tulajdonságaik
A gáz halmazállapotú metántiolt kivéve a kisebb szénatomszámú tiolok folyékonyak szobahőmérsékleten. Nagyon kellemetlen, átható szagú vegyületek. A tiolok forráspontja mindig alacsonyabb, mint a velük izológ hidroxilcsoportot tartalmazó vegyületek (alkoholok, fenolok). Ez azzal magyarázható, hogy a tiolok molekulái gyengébben asszociáltak, mint az alkoholoké (és a fenoloké), mert az -SH csoportjuk nem képes hidrogénkötéseket kialakítani. (Ez a különbség az alkoholok, illetve a tiolok szervetlen alapvegyületeinek tekinthető víznél és kén-hidrogénnél is fennáll.) A merkaptánok vízben kevésbé oldódnak, mint az alkoholok, az etántiol oldhatósága például 1,5 g / 100 g víz. Alkoholban és éterben viszont jól oldódnak. A tioalkoholok oldhatósága vízben a szénatomszámmal csökken, a nagyobb szénatomszámúak vízben gyakorlatilag oldhatatlanok.

Kémiai tulajdonságaik
Savi jelleg
A tiolok kifejezetten savjellegű vegyületek. A tioalkoholok erősebb savak, mint az alkoholok, ahogy a kén-hidrogén erősebb sav, mint a víz. Savi erősségük több nagyságrenddel nagyobb, mint az alkoholoké. A tiofenolok még erősebb savak, mint a tioalkoholok. Ennek az az oka, hogy a két szénhidrogéncsoport közül az alkilcsoport elektrontaszító, az aromás szénhidrogéncsoport elektronvonzó tulajdonságú. Gyenge savak, a pKs-ük értéke 11 körül van. Az alkoholokkal szemben tömény lúgokkal a tioalkoholok sókat képeznek, sóik kevésbé hidrolizálnak, mint az alkoholok sói. A tioalkoholok sói a merkaptidok vagy tiolátok, a tiofenolok sói a tiofenolátok.
A sóképzés nehézfémek oxidjaival, például higany-oxiddal is lejátszódik.
A tioalkoholok erősebb savak, mint az alkoholok, ezért a tioalkoholok sói, a tiolátok gyengébb bázisok, mint az alkoholátok. A tiolátok nukleofilitása viszont nagyobb, mint az alkoholátoké, annak megfelelően, hogy a periódusos rendszer egy oszlopán belül a nukleofilitás lefelé haladva nő.
Oxidációs reakciók
A tioalkoholok oxidációval szemben nem úgy viselkednek, mint az alkoholok. A tiolok oxidációra érzékenyek. Enyhe oxidációjuk során dehidrogéneződnek, diszulfidok keletkeznek belőlük. Enyhe oxidáció lejátszódhat jód, de akár a levegő oxigénje hatására is. A keletkező diszulfidok stabil vegyületek, de könnyen tiolokká redukálhatók, például katalitikus hidrogénezéssel. A tiolok enyhe oxidációja tehát reverzíbilis. A diszulfidkötések fontos szerepet játszanak a fehérjék harmadlagos szerkezetének kialakításában. A jód hatására végbemenő enyhe oxidáció reakcióegyenlete:
A tiolok erélyes oxidáció hatására szulfonsavakká oxidálódnak. Ez erélyes oxidálószerek, például hidrogén-peroxid vagy salétromsav hatására megy végbe. Ez a reakció több lépésben játszódik le.
Tioészterek képződése
A tioalkoholok karbonsavakkal (az alkoholokhoz hasonlóan) észtereket képeznek. A tioalkoholok észterei a tioészterek. A tioészterek reakcióképes vegyületek. Makroerg kötés található bennük, ami energiát szolgáltat ahhoz, hogy a tioészterről lehasadó acilgyök további reakciókba lépjen. A tioészterek képződésének reakcióegyenlete:
Reakció ketonokkal
A ketonokkal az alkoholokhoz hasonlóan reagálnak, a ketonok és a tioloalkoholok addíciós reakciójában ditioacetálok képződnek. A reakció könnyebben játszódik le, mint az alkoholok esetében.
Előállításuk
A tioalkoholok alkil-halogenidekből állíthatók elő nátrium-hidrogén-szulfid segítségével. Kálium-alkil-szulfátokból is keletkeznek kálium-hidrogén-szulfid hatására. Ezek a módszerek viszont aréntiolok (tiofenolok) előállítására csak ritkán használhatók.
Az aréntiolok aromás szulfonsav-kloridokból állíthatók elő redukcióval. A redukció cinkporral végezhető el, sósavas-híg kénsavas közegben.
Az aromás diazóniumsók eliminációs átalakításával is előállíthatók tiofenolok:
Fontos tiolok

- Az etántiol vagy elavult nevén etil-merkaptán színtelen, nagy hígításban is kellemetlen szagú folyadék. Forráspontja 35 °C. Vízben rosszul, alkoholban jól oldódik. Világszerte egyezményesen az eredetileg teljesen szagtalan földgáz szagosítására használják. A szaga mindenkinek gyakorlatilag egyet jelent a gáz jelenlétének feltételezésével, ami igen hasznos figyelmeztetés, lévén a földgáz az ember számára máshogy nem lenne érzékelhető. A szaginger már jóval a robbanásveszélyes koncentráció kialakulása előtt kellemetlenné és figyelemfelkeltővé erősödik, ezáltal megelőzhetővé téve egy esetleges katasztrófát.
- A tiofenol a benzol-szulfoklorid redukciójakor keletkezik. Kellemetlen szagú folyadék.
Szulfhidrilcsoportot tartalmazó, biológiailag jelentős vegyületek:
- A cisztein a 20 fehérjeeredetű aminosav egyike. A természetben az L enantiomerje fordul elő (L-cisztein). Oldalláncában szulfhidrilcsoportot tartalmaz. Két molekula ciszteinből enyhe oxidációval cisztin keletkezik. A cisztin diszulfidkötést tartalmaz, redukció hatására visszaalakul ciszteinné. A fehérjékben a ciszteinrészek közti diszulfidkötéseknek fontos szerepe van a fehérjék harmadlagos szerkezetének kialakításánál.
- A koenzim-A az acilcsoportok bevitelét katalizáló enzimek kofaktora. A nukleotid típusú koenzimek közé tartozik. A molekula felépítésében részt vesz az adenozin-3',5'-difoszfát pirofoszfát származéka, a pantoténsav, és a ciszteamin, ami peptidkötéssel kapcsolódik a pantoténsavhoz. Az aktív része a ciszteaminrész −SH (merkapto-) csoportja. Az acilcsoport ehhez kapcsolódik tioészterkötéssel. A legfontosabb koenzim-A-t tartalmazó vegyület az acetil-koenzim-A, ami fontos szerepet játszik például a citromsavciklusban illetve a zsírsavak lebontásában és felépítésében.
Források
- Bot György: A szerves kémia alapjai
- Bruckner Győző: Szerves kémia, I/1 és I/2-es kötetek
- Furka Árpád: Szerves kémia
- Kovács Kálmán, Halmos Miklós: A szerves kémia alapjai
Kapcsolódó szócikkek
- Tioéterek - A kéntartalmú szerves vegyületek egy másik csoportja
 Kémiaportál • összefoglaló, színes tartalomajánló lap
Kémiaportál • összefoglaló, színes tartalomajánló lap









![{\displaystyle \mathrm {[Ar{-}N{\equiv }N]^{+}Cl^{-}+KSH\rightarrow Ar{-}SH+KCl+N_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/156e610e63dd47586444a971925167b9adaf23ca)








