Benzilammina
| Benzilammina | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| 1-fenilmetilammina | |
| Nomi alternativi | |
| α-amminotoluene benzenmetanammina | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C7H9N |
| Massa molecolare (u) | 107,16 |
| Aspetto | liquido incolore |
| Numero CAS | 100-46-9 |
| Numero EINECS | 202-854-1 |
| PubChem | 7504 |
| DrugBank | DB02464 |
| SMILES | C1=CC=C(C=C1)CN |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,98 g/L |
| Indice di rifrazione | 1,5401 |
| Costante di dissociazione acida (pKa) a 298 K | 9,3 |
| Solubilità in acqua | miscibile |
| Temperatura di fusione | 10 °C (283,15 K) |
| Temperatura di ebollizione | 185 °C (458,15 K) |
| Tensione di vapore (Pa) a 293,15 K | 60 |
| Indicazioni di sicurezza | |
| Punto di fiamma | 65 °C (338,15 K) |
| Limiti di esplosione | 0,7 % - 8,2 % |
| Temperatura di autoignizione | 390 °C (663,15 K) |
| Simboli di rischio chimico | |
  | |
| pericolo | |
| Frasi H | 314 - 302 - 312 |
| Consigli P | 280 - 305+351+338 - 310 [1] |
| Modifica dati su Wikidata · Manuale | |
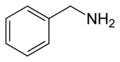
La benzilammina è un composto chimico con formula di struttura C6H5CH2NH2, è un'ammina ottenuta legando il gruppo -NH2 a un gruppo benzilico. Si presenta sotto forma di liquido incolore dall'odore di ammoniaca. Alla temperatura di 300 °C subisce decomposizione.[1]
Sintesi
La benzilamminna viene sintetizzata essenzialmente nei seguenti modi:[2]
- Reazione tra il cloruro di benzile e l'ammoniaca:
- Idrogenazione catalitica del benzonitrile:
- Amminazione riduttiva della benzaldeide:
Usi
La benzilammina è utilizzata nella sintesi di pigmenti e farmaci, oltre che come inibitore della corrosione.[2] La benzilammina viene anche utilizzata per la sintesi di altre ammine: dopo averla alchilata con un alogenuro alchilico è infatti possibile rimuovere il gruppo benzilico tramite idrogenolisi, con il conseguente ottenimento di un'ammina secondaria (R2NH).
Note
Bibliografia
- Mary Eagleson, Concise Encyclopaedia Chemistry, Walter de Gruyter & Co, 1994, ISBN 3-11-011451-8.
Altri progetti
Altri progetti
- Wikimedia Commons
 Wikimedia Commons contiene immagini o altri file su benzilammina
Wikimedia Commons contiene immagini o altri file su benzilammina
 Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia
Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia














