老人斑
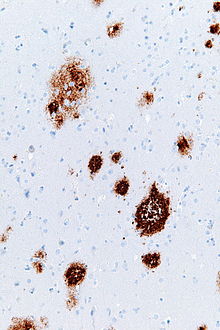
老人斑(ろうじんはん、英: senile plaques)は、脳の灰白質におけるアミロイドβの細胞外への沈着物である[1][2]。老人性プラークまたは神経突起斑 (neuritic plaques) とも呼ばれる。老人斑の沈着には、変性神経構造やミクログリアおよびアストロサイトの豊富さが関連している可能性がある。これらの沈着物はまた、老化/加齢の副産物である可能性がある。しかし、大量の老人斑と神経原線維変化(英語版)(NFT)はアルツハイマー病の特徴である。老人斑における異常な神経突起は、神経原線維変化の構成要素である対らせん状細線維 (paired helical filaments; PHF) で構成されている[3]。プラークの形状や大きさは様々であるが、平均して50 μm程度である[4]。アルツハイマー病では、それらは主にアミロイドβペプチドで構成されている。これらのポリペプチドは凝集する傾向があり、神経毒性があると考えられている。
歴史
1892年、ポール・ブロック(英語版)とゲオルゲ・マリネスク(英語版)は、灰白質中にプラーク状の沈着物が存在することを初めて報告した[5][6]。アクチノマイセス属放線菌の菌塊(ドルーゼ)に似ていることから、20世紀初頭にオスカー・フィッシャー(英語版)によってドルーゼ壊死症と呼ばれるようになった。プラークと認知症の関連性は、1906年にアロイス・アルツハイマーによって発見された[7]。1911年までにマックス・ビエルショウスキー(英語版)は、プラーク堆積物のアミロイド様の性質を提案した。同じ年、テオフィル・シムコヴィッツ(英語版)は、老人斑 (senile plaques) という用語を導入した[8]。Wisniewskiは1973年に神経斑 (neuritic plaques) という用語を造語した。20世紀後半には、プラーク形成における免疫学的および遺伝学的要因に関する理論が提案された[9]。1970年代には、J. A. N. CorsellisとM. Frankeによって統計的な調査が行われた。Frankeは、前頭皮質の老人斑の数が200 mm−3以上になると痴呆性疾患になる可能性があることを示した。1985年には生化学的手法によりβアミロイド形成の同定に成功したが、老人斑の重要性や形成については多くの未解決の疑問が残されていた。
形成と説明
神経細胞のシナプスに集中しているのは、形質膜を横切って広がるアミロイド前駆体タンパク質(APP)である。このタンパク質の一部には Aβペプチド配列が含まれている。この領域は、タンパク質をコードするAPPにまたがるDNAセグメントの一部を構成している[10]。
老人斑の形成においては、アミロイド前駆体タンパク質からAβが切断される。APPを処理できる酵素は3種類あるが、老人斑の形成に直接関与しているのはβ-セクレターゼとγ-セクレターゼのみである。β-セクレターゼ (BACE) は、タンパク質やペプチドを切断するプロテアーゼ酵素である。このプロテアーゼはAPPを切断して、AβのC末端断片をさらに露出させる。このプロセスによってAPPの大部分が解放された後、γ-セクレターゼが、膜貫通(英語版)ドメイン上の残りのC末端断片を切断する。BACE活性に続くγ-セクレターゼの一連の作用により、Aβタンパク質断片(アミロイドβ)が細胞外空間に放出される[10]。最終的には、神経細胞のシナプスの外側にアミロイドβが蓄積すると、脳細胞の微細な隆起や結合を押しのけるプラークの集合体を形成する。
アミロイドβ断片の形成は、人間の体内では正常な出来事である。しかし、プラーク沈着の形成につながるAβの蓄積は異常な現象である。この異常の原因はほとんど解明されていないが、研究の結果、数種類のアミロイドβが数個のアミノ酸の長さの違いで凝集してプラークになりやすいことが明らかになっている。これらの種はより病原性が高い[11]。
識別

老人斑は、銀染色、コンゴーレッド、チオフラビン(英語版)、クレシルバイオレット(英語版)、PAS反応などの染色法を用いて、光学顕微鏡で見ることができる。プラーク沈着物は、蛍光顕微鏡や免疫蛍光顕微鏡でも確認できる[3][12]。ビルショウスキー銀染色(英語版)は、老人斑を可視化する最も非効率な方法であることがわかったのに対し、キャンベルとガリヤスの銀染色技術は、識別と精度の向上が示された。コンゴーレッドを用いると、存在する老人斑の4分の1のみが著しく染色された[11]。老人斑は、βアミロイドに対する免疫染色でも可視化することができる。上記の染色法の第一の問題点は、老人斑を正確に識別するためには、脳から神経組織の切片を切除しなければならないことである。神経組織を切除することは、実際のプラークそのものと同様に有害であるため、これには問題がある。
疾患
アルツハイマー病の神経病理学的・歴史学的検証の重要な基準は、老人斑の形成である。老人斑に関連するβアミロイドペプチドは、アルツハイマー病のリスク、発症、進行にも中心的な役割を果たしていることがわかっている。特に重要なのは、βアミロイド42 (Aβ42) として知られる長いβアミロイドである。βアミロイドのレベルの上昇、およびβアミロイド42の、より短い主要種βアミロイド40 (Aβ40) に対する比率の上昇は、アルツハイマー病の病態形成の初期のイベントにおいて重要であると識別されている[13]。
アルツハイマー病の検証における他の要因としては、病理学的な神経原線維、もつれ、水頭症を伴う萎縮性脳などが挙げられる。病理学的な神経原線維の形成と分布には規則性があり[14]、疾患の病期を判断することができる。多数のプラークの発生と相まって、アルツハイマー病は高確率で診断できる。また、老人斑の存在とダウン症との相関性も確認されている[1]。
発生
老人斑は、ヒトや動物の脳(哺乳類や鳥類など)にも見られる。60歳 (10%) から80歳 (60%) になると、老人斑のある人の割合は直線的に増加する。形成されるプラークのごく一部は、老化の生理的プロセスによるものである可能性がある。女性は男性に比べてわずかにプラークの発生率が高い[4]。プラークは、通常、扁桃核や大脳皮質の溝に多く発生する。
研究
βアミロイドレベルを低下させる化合物の種類が増えてきている[15]。これらの化合物のいくつかはβアミロイド42の選択性を持っているが、他の化合物はアミロイド前駆体タンパク質を調節しようとしている。このような化合物は現在、アルツハイマー病の治療にどのように役立つかを決定するために、臨床評価に達している[13]。
出典
- ^ a b Cras P; Kawai M; Lowery D; Gonzalez-DeWhitt P; Greenberg B; Perry G (September 1991). “Senile plaque neurites in Alzheimer disease accumulate amyloid precursor protein”. Proceedings of the National Academy of Sciences of the United States of America 88 (17): 7552–6. doi:10.1073/pnas.88.17.7552. PMC 52339. PMID 1652752. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC52339/.
- ^ Purves, Dale; Augustine, George J.; Fitzpatrick, David; Hall, William C.; LaManita, Anthony-Samuel; White, Leonard E.; Mooney, Richard D.; Platt, Michael L. (2012). Neuroscience (5th ed.). Sunderland, MA: Sinauer Associates. p. 713. ISBN 978-0-87893-695-3
- ^ a b Ksiezak-Reding H, Morgan K, Mattiace LA, etal (December 1994). “Ultrastructure and biochemical composition of paired helical filaments in corticobasal degeneration”. The American Journal of Pathology 145 (6): 1496–508. PMC 1887493. PMID 7992852. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1887493/.
- ^ a b “Statistische Untersuchungen über die senilen Drusen im menschlichen Gehirn / Thesen”. Berlin, Germany: Neuropathologische Abteilung (1976年). 2011年7月19日時点のオリジナルよりアーカイブ。2020年7月24日閲覧。
- ^ Blocq, Paul; Marinesco, Georges (1892). Sur les lesions et la pathogenie de l'epilepsie dite essentielle. pp. 445–6. OCLC 492619936
- ^ Buda O; Arsene D; Ceausu M; Dermengiu D; Curca GC (January 2009). “Georges Marinesco and the early research in neuropathology”. Neurology 72 (1): 88–91. doi:10.1212/01.wnl.0000338626.93425.74. PMID 19122036.
- ^ Alzheimer, A (1907). “Uber einen eigenartige Erkranung der Hirnrinde”. Allgemeine Zeitschrift für Psychiatrie und Psychisch-Gerichtlich Medizin 64: 146–8.
- ^ Simchowicz T.: Histologische Studien über die senile Demenz. in: Nissl F., Alzheimer A. (Hrsg.): Histologische und histopathologische Arbeiten über die Grosshirnrinde mit besonderer Berücksichtigung der pathologischen Anatomie der Geisteskrankheiten. Jena: G. Fischer, 1911, p. 267–444.
- ^ Op den Velde W; Stam FC (January 1976). “Some cerebral proteins and enzyme systems in Alzheimer's presenile and senile dementia”. Journal of the American Geriatrics Society 24 (1): 12–6. doi:10.1111/j.1532-5415.1976.tb03247.x. PMID 1244383.
- ^ a b Suh YH; Checler F (September 2002). “Amyloid precursor protein, presenilins, and alpha-synuclein: molecular pathogenesis and pharmacological applications in Alzheimer's disease”. Pharmacological Reviews 54 (3): 469–525. doi:10.1124/pr.54.3.469. PMID 12223532.
- ^ a b Mavrogiorgou P; Gertz HJ; Ferszt R; Wolf R; Bär KJ; Juckel G (December 2011). “Are routine methods good enough to stain senile plaques and neurofibrillary tangles in different brain regions of demented patients?”. Psychiatria Danubina 23 (4): 334–9. PMID 22075733. http://www.hdbp.org/psychiatria_danubina/pdf/dnb_vol23_no4/dnb_vol23_no4_334.pdf.
- ^ Lamy C, Duyckaerts C, Delaere P, etal (1989). “Comparison of seven staining methods for senile plaques and neurofibrillary tangles in a prospective series of 15 elderly patients”. Neuropathology and Applied Neurobiology 15 (6): 563–78. doi:10.1111/j.1365-2990.1989.tb01255.x. PMID 2482455.
- ^ a b Findeis MA (November 2007). “The role of amyloid beta peptide 42 in Alzheimer's disease”. Pharmacology & Therapeutics 116 (2): 266–86. doi:10.1016/j.pharmthera.2007.06.006. PMID 17716740.
- ^ Braak H; Braak E; Bohl J (1993). “Staging of Alzheimer-related cortical destruction”. European Neurology 33 (6): 403–8. doi:10.1159/000116984. PMID 8307060.
- ^ Irwin K Cheah, Li-Theng Ng, Li-Fang Ng , Vanessa Y Lam, Jan Gruber, Cheryl Y W Huang, Fang-Qin Goh, Keith H C Lim, Barry Halliwell (August 2019). “Inhibition of amyloid-induced toxicity by ergothioneine in a transgenic Caenorhabditis elegans model”. FEBS Lett. 593 (16): 2139–2150. doi:10.1002/1873-3468.13497. PMID 31211853.
推薦文献
- Jellinger KA. Neurodegenerative Erkrankungen (ZNS) - Eine aktuelle Übersicht. Journal für Neurologie, Neurochirurgie und Psychiatrie. 2005;6(1):9-18.
- Cruz L, Urbanc B, Buldyrev SV, etal (July 1997). “Aggregation and disaggregation of senile plaques in Alzheimer disease”. Proceedings of the National Academy of Sciences of the United States of America 94 (14): 7612–6. doi:10.1073/pnas.94.14.7612. PMC 23870. PMID 9207140. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC23870/.





