Kalijum superoksid
 | |
| Nazivi | |
|---|---|
| IUPAC naziv Kalijum-dioksid | |
| Drugi nazivi Kalijum superoksid | |
| Identifikacija | |
| |
3D model (Jmol) |
|
| ECHA InfoCard | 100.031.574 |
| |
| RTECS | TT6053000 |
SMILES
| |
| Svojstva | |
| KO2 | |
| Molarna masa | 71,10 g·mol−1 |
| Agregatno stanje | žita čvrsta materija |
| Gustina | 2,14 g/cm3, čvrst |
| Tačka topljenja | 560 °C (1.040 °F; 833 K) |
Rastvorljivost u vodi | razlaže se |
| Struktura | |
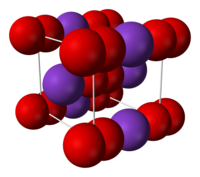
| Kristalna rešetka/struktura | centralna kubna (O2-) |
| Termohemija | |
| Standardna molarna entropija S | 117 J·mol−1·K−1[3] |
Std entalpija formiranja (ΔfH⦵298) | −283 kJ·mol−1[3] |
| Opasnosti | |
| Opasnost u toku rada | Korozivan, oksidans |
| R-oznake | 8-14-34 |
| S-oznake | 17-27-36/37/39 |
| NFPA 704 |  0 3 3 OX |
| Srodna jedinjenja | |
Drugi anjoni | Kalijum oksid Kalijum peroksid |
Drugi katjoni | Natrijum superoksid |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |
 Y verifikuj (šta je Y verifikuj (šta je  Y Y Н ?) Н ?) | |
| Reference infokutije | |
Kalijum superoksid je hemijsko jedinjenje sa formulom KO2. Ova retka so superoksidnog jona se formira sagorevanjem rastopljenog kalijuma u čistom kiseoniku. Kalijum superoksid se koristi kao oksidacioni agens u industrijskoj hemiji, kao sredstvom za uklanjanje CO2 i H2O iz vazduha, i kao O2 generator u bocama za ronjenje, svemirskim letelicama podmornicama
Važne reakcije:
- 4 KO2 + 2 H2O → 4 KOH + 3 O2
- 2 KOH + CO2 → K2CO3 + H2O
- K2CO3 + CO2 + H2O → 2 KHCO3
- 4 KO2 + 2 CO2 → 2 K2CO3 + 3 O2
Strukturni trendovi
Derivati-dioksidaa, O2, imaju karakteristično O-O rastojanje koje je u korelaciji sa redom O-O veze.
| Dikiseonikčno jedinjenje | Ime | O-O rastojanje u Å | Red O-O veze |
|---|---|---|---|
| O2+ | -dioksidni katjon | 1.12 | 2.5 |
| O2 | dikiseonik | 1.21 | 2 |
| O2- | superoksid | 1.28 | 1.5[4] |
| O22- | peroksid | 1.49 | 1 |
Reference
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003. уреди
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. стр. A22. ISBN 978-0-618-94690-7.
- ^ Abrahams, S. C.; Kalnajs, J. "The Crystal Structure of α-Potassium Superoxide" Acta Crystallographica (1955) volume 8, pages 503-506. . doi:10.1107/S0365110X55001540. Недостаје или је празан параметар
|title=(помоћ).
Literatura
Spoljašnje veze
- п
- р
- у
Jedinjenja kalijuma
KBr · KBrO3 · KCN · KCNO · KCl · KClO3 · KClO4 · KF · KH · KHCO2 · KHCO3 · KHF2 · KHSO3 · KHSO4 · KH2AsO4 · KI · I2KI · KIO3 · KIO4 · KMnO4 · KN3 · KNO2 · KNO3 · KOCN · KOH · KO2 · KPF6 · KSCN · K2CO3 · K2CrO4 · K2Cr2O7 · K2FeO4 · K2MnO4 · K2O · K2O2 · K2PtCl4 · K2PtCl6 · K2S · K2SO3 · K2SO4 · K2SO5 · K2S2O5 · K2S2O7 · K2S2O8 · K2SiO3 · K3[Fe(CN)6] · K3[Fe(C2O4)3] · K4[Fe(CN)6] · K3PO4 · K4MnO4 · K4Mo2Cl8

Kalijum superoksid на Викимедијиној остави.









