Enllaç carboni-carboni
Els compostos d'organocarboni (o compostos orgànics del carboni) són compostos químics que contenen un enllaç químic entre carboni (C) i carboni (C) (enllaç C-C).[1] La química de l'organocarboni és la ciència corresponent que explora les propietats, l'estructura i la reactivitat d'aquests compostos.
La forma més comuna és l'enllaç simple: un enllaç format per dos electrons, un de cadascun dels dos àtoms. L'enllaç únic carboni-carboni és un enllaç sigma i es forma entre un orbital hibridat de cadascun dels àtoms de carboni. A l'età, els orbitals són orbitals hibridats amb sp3, però també es produeixen enllaços simples formats entre àtoms de carboni amb altres hibridacions (per exemple, sp2 a sp2).
De fet, els àtoms de carboni de l'enllaç senzill no necessiten ser de la mateixa hibridació. Els àtoms de carboni també poden formar enllaços dobles en compostos anomenats alquens o enllaços triples en compostos anomenats alquins. Es forma un doble enllaç amb un orbital hibridat sp2 i un orbital p que no està implicat en la hibridació. Es forma un enllaç triple amb un orbital sp hibridat i dos orbitals p de cada àtom. L'ús dels orbitals p forma un enllaç pi.
Cadenes i ramificacions
El carboni és un dels pocs elements que pot formar llargues cadenes dels seus propis àtoms, una propietat anomenada catenació. Això unit a la força de l'enllaç carboni-carboni dóna lloc a un nombre enorme de formes moleculars, moltes de les quals són elements estructurals importants de la vida, de manera que els compostos de carboni tenen el seu propi camp d'estudi: la química orgànica.
-
 2,2,3-trimetilpentà
2,2,3-trimetilpentà
La ramificació també és freqüent en els esquelets C−C. Els àtoms de carboni d'una molècula es classifiquen segons el nombre de veïns de carboni que tenen:[2][3]
- Un carboni primari té un carboni veí.
- Un carboni secundari té dos carbonis veïns.
- Un carboni terciari té tres carbonis veïns.
- Un carboni quaternari té quatre carbonis veïns.
| Carboni primari | Carboni secundari | Carboni terciari | Carboni quaternari | |
| Estructura general (R = grup organil) |  |  |  |  |
| Estructura parcial Fórmula estructural |  |  |  |  |
En les «molècules orgàniques estructuralment complexes», és l'orientació tridimensional dels enllaços carboni-carboni en els llocs quaternaris la que dicta la forma de la molècula. A més, els loci quaternaris es troben en moltes molècules petites biològicament actives, com la cortisona i la morfina.[4]
Síntesi
Les reaccions de formació d'enllaç carboni-carboni són reaccions orgàniques en les quals es forma un nou enllaç carboni-carboni. Són importants en la producció de molts productes químics artificials com ara productes farmacèutics i plàstics.
Alguns exemples de reaccions que formen enllaços carboni-carboni són les reaccions aldòliques, les reaccions de Diels-Alder, l'addició d'un reactiu de Grignard a un grup carbonil, una reacció de Heck, una reacció de Michael i una reacció de Wittig.
La síntesi dirigida de les estructures tridimensionals desitjades per a carbonis terciaris es va resoldre en gran manera a finals del segle xx, però la mateixa capacitat per dirigir la síntesi de carboni quaternari no va començar a sorgir fins a la primera dècada del segle xxi.[4]
Força i longitud d'enllaç
L'enllaç senzill carboni-carboni és més feble que els enllaços C-H, O-H, N-H, H-H, H-Cl, C-F i molts enllaços dobles o triples, i és comparable en força als enllaços C-O, Si-O, P-O i SH,[5] però habitualment és considerat com a fort.
| Enllaç C–C | Molècula | Energia de dissociació de l'enllaç (kcal/mol) |
|---|---|---|
| CH₃−CH₃ | età | 90 |
| C₆H₅−CH₃ | toluè | 102 |
| C₆H₅−C₆H₅ | bifenil | 114 |
| CH₃C(O)−CH₃ | acetona | 84 |
| CH₃−CN | acetonitril | 136 |
| CH₃−CH₂OH | ethanol | 88 |
Els valors indicats anteriorment representen energies de dissociació d'enllaços C-C que es troben habitualment; ocasionalment, els valors atípics poden desviar-se dràsticament d'aquest rang.
| Molècula | Età | Etè (o Etilè) | Etí (o Acetilè) |
|---|---|---|---|
| Fórmula | C₂H₆ | C₂H₄ | C₂H₂ |
| Tipus d'enllaç | senzill | doble | triple |
| Estructura | 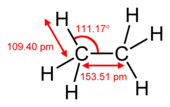 |  |  |
| Hibridació del carboni | sp3 | sp2 | sp |
| Longitud de l'enllaç C-C | 153.5 pm | 133.9 pm | 120.3 pm |
| Proporció en relació a l'enllaç C-C | 100% | 87% | 78% |
| Mètode de determinació de l'estructura | espectroscòpia de rotació | espectroscòpia de rotació | Espectroscòpia infraroja |
Casos extrems
Enllaços senzill C-C, llargs i febles
S'han identificat diversos casos extrems on l'enllaç C-C és allargat. En el dímer de Gomberg, un enllaç C-C és bastant llarg (159,7 picòmetres). Aquest enllaç és el que es trenca de manera reversible i ràpida a temperatura ambient en solució.[6]
-
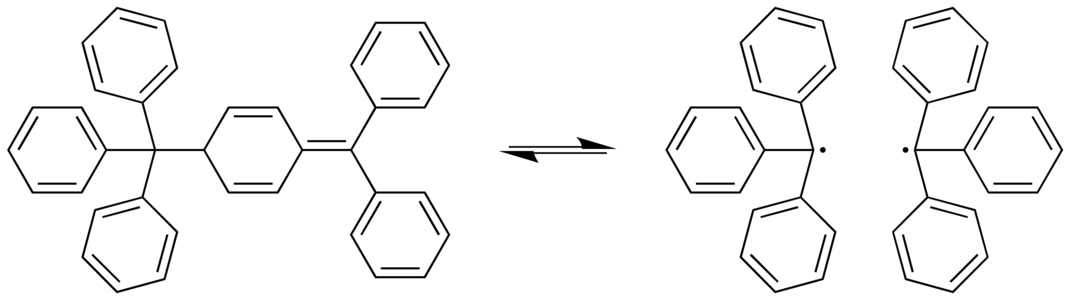 Dissociació del dímer de Gomberg
Dissociació del dímer de Gomberg
A la molècula encara més congestionada hexakis(3,5-di-tert-butilfenil)età, l'energia de dissociació de l'enllaç per formar el radical triarilmetil estabilitzat és només de 8 kcal/mol. També com a conseqüència de la seva severa congestió estèrica, l'hexakis(3,5-di-tert-butilfenil)etaà té un enllaç central molt allargat amb una longitud de 167 pm.[7]
Dobles enllaços C=C, retorçats i febles
L'estructura del tetrakis(dimetilamino)etilè (TDAE) està molt distorsionada. L'angle díedre dels dos extrems N₂C és de 28º encara que la distància C=C és normal de 135 pm. El tetraisopropiletilè gairebé isoestructural també té una distància C=C de 135 pm, però el seu nucli C₆ és pla.[8]
Enllaços triples C≡C, curts i forts
A l'extrem oposat, l'enllaç senzill carboni-carboni central del diacetilè és molt fort (160 kcal/mol), ja que l'enllaç senzill uneix dos carbonis d'hibridació sp. Els enllaços múltiples carboni-carboni són generalment més forts; s'ha determinat que el doble enllaç de l'etilè i el triple enllaç de l'acetilè tenen energies de dissociació d'enllaç de 174 i 230 kcal/mol, respectivament.[9]
S'ha observat un triple enllaç molt curt de 115 pm per a les espècies d'iodini [HC≡C–I+Ph][CF₃SO₃–], a causa de la part de iodoni fortament extreta d'electrons.[10]
Referències
- ↑ Dembicki, 2016, p. 7.
- ↑ Smith, 2011, p. 116.
- ↑ Latscha, Kazmaier i Klein, 2016, p. 40.
- ↑ 4,0 4,1 Quasdorf i Overman, 2014, p. 181-191.
- ↑ 5,0 5,1 Luo, Yu-Ran; Cheng, Jin-Pei. «Bond Dissociation Energies». A: Handbook of Chemistry and Physics (en anglès). CRC.
- ↑ Bochkarev et al., Yanovsky, p. 489-491.
- ↑ Rösel, Balestrieri i Schreiner, 2017, p. 405-410.
- ↑ Bock et al., Ruppert, p. 1678-1681.
- ↑ Blanksby i Ellison, 2003, p. 255-263.
- ↑ Streitwieser, Heathcock i Kosower, 1992, p. 574.
Bibliografia
- Blanksby, Stephen J.; Ellison, G. Barney «Bond Dissociation Energies of Organic Molecules» (en anglès). Accounts of Chemical Research, 36(4), abril 2003. DOI: 10.1021/ar020230d. ISSN: 0001-4842. PMID: 12693923.
- Bochkarev, L. N.; Molosnova, N. E.; Zakharov, L. N.; Fukin, G. K.; Yanovsky, A. I.; Struchkov, Y. T. «1-Diphenylmethylene-4-(triphenylmethyl)cyclohexa-2,5-diene Benzene Solvate» (en anglès). Acta Crystallographica (Section C. Crystal Structure Communications), 51(3), 1995. DOI: 10.1107/S0108270194009005.
- Bock, Hans; Borrmann, Horst; Havlas, Zdenek; Oberhammer, Heinz; Ruppert, Klaus; Simon, Arndt «Tetrakis(dimethylamino)ethene: An Extremely Electron-Rich Molecule with Unusual Structure both in the Crystal and in the Gas Phase» (en anglès). Angewandte Chemie International Edition in English, 30(12), 1991. DOI: 10.1002/anie.199116781.
- Dembicki, Harry. Practical Petroleum Geochemistry for Exploration and Production (en anglès). Elsevier, 2016. ISBN 9780128033517.
- Latscha, Hans Peter; Kazmaier, Uli; Klein, Helmut Alfons. Organische Chemie: Chemie-Basiswissen II (en alemany). Berlín: Springer Spektrum, 2016. ISBN 978-3-662-46180-8.
- Quasdorf, Kyle W.; Overman, Larry E. «Review: Catalytic enantioselective synthesis of quaternary carbon stereocentres» (en anglès). Nature, 516(7530), 2014. Bibcode: 2014Natur.516..181Q. DOI: 10.1038/nature14007. PMC: 4697831. PMID: 25503231.
- Rösel, Sören; Balestrieri, Ciro; Schreiner, Peter R. «Sizing the role of London dispersion in the dissociation of all-meta tert-butyl hexaphenylethane» (en anglès). Chemical Science, 8(1), 2017. DOI: 10.1039/c6sc02727j. ISSN: 2041-6520. PMC: 5365070. PMID: 28451185.
- Smith, Janice Gorzynski. «cap. 4. Alkanes». A: Organic chemistry (en anglès). Nova York: McGraw-Hill, 2011. ISBN 978-0-07-337562-5.
- Streitwieser, Andrew; Heathcock, Clayton H.; Kosower, Edward M. Introduction to organic chemistry (en anglès). Upper Saddle River, N.J.: Prentice Hall, 1992. ISBN 978-0139738500. OCLC 52836313.



