Fosfofruktokinaza-1
| 6-fosfofruktokinaza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Identifikatori | |||||||||
| EC broj | 2.7.1.11 | ||||||||
| CAS broj | 9001-80-3 | ||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG entry | ||||||||
| MetaCyc | metabolic pathway | ||||||||
| PRIAM | profile | ||||||||
| PDB | RCSB PDB PDBe PDBj PDBsum | ||||||||
| Ontologija gena | AmiGO / EGO | ||||||||
| |||||||||
Fosfofruktokinaza-1 (PFK-1) je jedan od najvažnijih regulatornih enzima (EC 2.7.1.11) glikolize. Ona je alosterni enzim formiran od 4 podjedinice i kontrolisan mnogim aktivatorima i inhibitorima. PFK-1 katalizuje korak glikolize u kome se konvertuju fruktoza 6-fosfat i ATP u fruktozu 1,6-bisfosfat i ADP.
| β-D-fruktoza 6-fosfat | Fosfofruktokinaza-1 | β-D-fruktoza 1,6-bisfosfat | |
 |  | ||
| ATP | ADP | ||
 | |||
| Pi | H2O | ||
| Fruktoza bisfosfataza | |||
Struktura
PFK1 sisara je 340 kD[1] tetramer koji se sastoji od tri tipa podjedinica: mišićne (M), jetrene (L), i trombocitne (P). Sastav PFK1 tetramera se ralikuje u zavisnosti od tipa tkiva u kome su prisutni. Na primer, mišići izražavaju samo M izozim, te su mišićni PFK1 homotetrameri, M4. Jetra i bubrezi predominantno izražavaju L izoformu. Eritrociti izražavaju M i L podjedinice koji se randomno tetramerizuju u M4, L4 i tri hibridne forme enzima (ML3, M2L2, M3L). Kinetička i regulatorna svojstva različitih izoformi su zavisna od kompozicije. Tkivno specifične promene PFK aktivnosti i izoenzimski sadržaj znatno doprinose raznovrsnosti glikolitičke i glukoneogenske brzine u raličitim tkivima.[2]
PFK1 je alosterni enzim čija struktura je slična sa hemoglobinom. On je dimer dimera.[3] Jedna polovina svakog dimera sadrži mesto vezivanja ATP molekula, dok je u drugoj polovini mesto vezivanja supstrata (fruktoze 6-fosfata ili F6P), kao i zasebno alosterno mesto vezivanja.[4]
Reference
- ↑ Greška u referenci: Nevaljana oznaka
<ref>; nije zadan tekst za reference po imenuStryer - ↑ Greška u referenci: Nevaljana oznaka
<ref>; nije zadan tekst za reference po imenuDunaway - ↑ PDB 4pfk; Evans PR, Farrants GW, Hudson PJ (June 1981). „Phosphofructokinase: structure and control”. Philos. Trans. R. Soc. Lond., B, Biol. Sci. 293 (1063): 53–62. DOI:10.1098/rstb.1981.0059. PMID 6115424. Lay summary – PDB Molecule of the Month.
- ↑ Greška u referenci: Nevaljana oznaka
<ref>; nije zadan tekst za reference po imenuShirakihara
Literatura
- Nicholas C. Price, Lewis Stevens (1999). Fundamentals of Enzymology: The Cell and Molecular Biology of Catalytic Proteins (Third izd.). USA: Oxford University Press. ISBN 019850229X.
- Eric J. Toone (2006). Advances in Enzymology and Related Areas of Molecular Biology, Protein Evolution (Volume 75 izd.). Wiley-Interscience. ISBN 0471205036.
- Branden C, Tooze J.. Introduction to Protein Structure. New York, NY: Garland Publishing. ISBN: 0-8153-2305-0.
- Irwin H. Segel. Enzyme Kinetics: Behavior and Analysis of Rapid Equilibrium and Steady-State Enzyme Systems (Book 44 izd.). Wiley Classics Library. ISBN 0471303097.
- Robert A. Copeland (2013). Evaluation of Enzyme Inhibitors in Drug Discovery: A Guide for Medicinal Chemists and Pharmacologists (2nd izd.). Wiley-Interscience. ISBN 111848813X.
- Gerhard Michal, Dietmar Schomburg (2012). Biochemical Pathways: An Atlas of Biochemistry and Molecular Biology (2nd izd.). Wiley. ISBN 0470146842.
[3] }}
Vidi još
- PFK2
- PFP
- Fruktoza bisfosfataza
Spoljašnje veze
- MeSH Phosphofructokinase-1
- Proteopedia.org Phosphofructokinase
- p
- r
- u
| Glukoza | Heksokinaza | Glukoza 6-fosfat | Glukoza 6-fosfat izomeraza | Fruktoza 6-fosfat | fosfofruktokinaza-1 | Fruktoza 1,6-bisfosfat | Fruktoza-bisfosfat aldolaza | ||||
 | ATP | ADP | 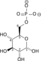 |  | ATP | ADP |  | ||||
 |  |  |  | ||||||||
| Dihidroksiaceton fosfat | Gliceraldehid 3-fosfat | Triozafosfat izomeraza | Gliceraldehid 3-fosfat | Gliceraldehid-3-fosfat dehidrogenaza | 1,3-Bisfosfoglicerat | |||||
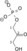 | 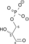 |  | NAD+ + Pi | NADH + H+ |  | |||||
| + |  | 2 |  | 2 | ||||||
| Fosfoglicerat kinaza | 3-Fosfoglicerat | Fosfoglicerat mutaza | 2-Fosfoglicerat | Fosfopiruvat hidrataza(Enolaza) | Fosfoenolpiruvat | Piruvat kinaza | Piruvat | ||||||||
| ADP | ATP | 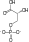 |  | H2O | 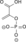 | ADP | ATP |  | |||||||
 | 2 |  | 2 |  | 2 |  | 2 | ||||||||
| |||||
- ↑ Stryer, Lubert; Berg, Jeremy Mark; Tymoczko, John L. (2007). Biochemistry (Sixth izd.). San Francisco: W.H. Freeman. ISBN 0-7167-8724-5.
- ↑ Dunaway GA, Kasten TP, Sebo T, Trapp R (May 1988). „Analysis of the phosphofructokinase subunits and isoenzymes in human tissues”. Biochem. J. 251 (3): 677–83. PMC 1149058. PMID 2970843.
- ↑ Shirakihara Y, Evans PR (December 1988). „Crystal structure of the complex of phosphofructokinase from Escherichia coli with its reaction products”. J. Mol. Biol. 204 (4): 973–94. DOI:10.1016/0022-2836(88)90056-3. PMID 2975709.









